
LES CARBURANTS POUR FUSEES
Un moteur-fusée fonctionne en transformant en énergie cinétique l'énergie dégagée lors de la réaction chimique entre deux composés: un oxydant et un réducteur, appelés respectivement comburant et combustible. Ces substances, dont la réaction assure la propulsion, sont appelées propergols. Selon la nature du couple comburant/combustible, on distingue des propergols solides et des propergols liquides.
Propergols liquides
Les propergols les plus fréquents sont des diergols, c'est-à-dire à deux liquides, l'un comburant et l'autre combustible, stockés séparément.
Le couple de propergols doit assurer une impulsion spécifique importante, et avoir une température de combustion élevée produisant un gaz de faible masse molaire. De plus, pour faciliter le stockage, leur masse volumique ne doit pas être trop faible. On distingue ainsi les ergols qui peuvent être conservés à température ambiante plusieurs jours, comme le tétraoxyde d'azote ou l'UDMH (diméthyl-hydrazine dissymétrique), et les ergols cryotechniques, qui nécessitent un stockage à très basse température. Par exemple, l'oxygène, comburant cryogénique dont la température d'ébullition est de - 183 °C, ne peut pas rester longtemps dans un réservoir, et doit être rapidement vidangé en cas de report du tir.
Les couples de propergols peuvent être hypergoliques, c'est-à-dire qu'ils entrent spontanément en réaction dès qu'ils se trouvent en contact. C'est le cas du couple tétraoxyde d'azote/UDMH, dont la température de combustion est de 2 800 °C pour une vitesse d'éjection de 2 900 m/s dans le vide.
La diméthylhydrazine ou UDMH de formule H2N – N(CH3)2 est un ergol liquide stockable utilisé comme combustible dans les moteurs des étages inférieurs de nombreux lanceurs. C’est un liquide incolore à odeur ammoniacale qui se décompose spontanément vers 400°C sous la pression atmosphérique en donnant du méthane et du diazote.
Les propergols liquides sont moins stables et d'un maniement plus délicat que les propergols solides. L'hydrazine est, par exemple, un composé très corrosif, et l'UDMH, utilisé pour le premier étage d'Ariane, est un composé très toxique.
Propergols solides
Les propergols solides sont des matériaux combustibles mais stables à température ordinaire. On distingue des propergols homogènes et des propergols hétérogènes, ou composites.
Les propergols homogènes, comme la nitrocellulose, sont des composés chimiques dont la combustion a une impulsion spécifique assez réduite. Leur discrétion justifie leur utilisation par les engins militaires de type tactique.
Les propergols composites sont formés par un combustible, généralement un sel minéral, finement disséminé dans la masse de comburant, souvent du perchlorate d'ammonium. Ainsi, l'aluminium est le combustible des propulseurs d'appoint de la navette spatiale américaine. L'ensemble est lié et stabilisé par un liant organique, tel que le polybutadiène ou le chlorure de vinyle. Le mélange est préparé et moulé sous forme de pains allant de quelques grammes à 500 t dans le cas des propulseurs à poudre de la navette spatiale. La forme des pains de poudre déterminera la progression de la combustion: formes cylindriques pour une poussée progressive, en étoile, à ailettes pour une double poussée.
Pour doper les performances des propergols solides, on y incorpore parfois une faible quantité d'explosif. L'impulsion spécifique en est améliorée, mais au détriment de la stabilité et de la résistance à l'humidité.
Les propergols solides sont stables et facilement stockables. Ils présentent cependant un inconvénient majeur: une fois la combustion commencée, rien ne peut l'arrêter.
La recherche de propergols utilisables par les statoréacteurs des futurs avions supersoniques suppose de mettre au point un couple fonctionnant en milieu aérobie et anaérobie; on utiliserait ainsi une première combustion dégageant des gaz primaires réducteurs pour permettre ensuite une seconde combustion à partir de l'oxygène de l'air. Ce type de propulsion assure de très hautes impulsions spécifiques, mais s'avère techniquement complexe et difficile à maîtriser.
Durant le XIXe siècle, le kérosène, aussi appelé pétrole lampant, était presque exclusivement utilisé à des fins d'éclairage. Ce ne fut qu'à partir des années 1950 qu'il trouva une importance industrielle, car les carburants employés dans les avions à réaction sont fabriqués avec du kérosène. V. aussi propergol
Le
terme propergol désigne à la fois le carburant et le comburant nécessaires à
la marche de la fusée. On définit le rapport de mélange qui est le rapport
entre la masse de comburant et de celle de combustible. Pour éviter qu’il ne
reste que le comburant ou le carburant à la fin du vol, on fait varier le
rapport de mélange au cours du lancement.
Il
existe deux grandes catégories de propergols : les propergols solides et
les propergols liquides.
Les
propergols solides sont couramment appelés propergols à poudre parce qu’ils
étaient originairement fabriqués à l’aide de composés pulvérulents. Ils
sont aujourd’hui composés d’une matière caoutchouteuse qui correspond au
carburant et au comburant (oxydant) qui sont coulés sous forme solide, avec
adjonction de produits stabilisateurs qui évitent des réactions prématurées
et parasites. Ces propergols sont utilisés dans les étages d’accélération
et les boosters (impulsion de l’ordre de 180s.)
On
taille à l’intérieur du bloc solide une entaille en forme d’étoile afin d’assurer
une combustion homogène et constante. Celle-ci s’effectue à partir de l’allumage :
un système de type bougie ou résistance électrique en général fait
vaporiser une partie du solide. Cette vapeur vient au contact du propergol qui
se consume et engendre des vapeurs à son tour. La combustion a lieu à l’intérieur
même du réservoir qui sert de chambre de combustion.
Les
propergols liquides sont de deux types : les propergols liquides stockables
et les propergols cryogéniques. On peut citer comme propergols stockables le
mélange peroxyde d’azote N2O4 qui est l’oxydant et l’hydrazine
ou ses dérivés (UDMH) comme combustible.
Les
propergols cryotechniques sont gazeux à pression et température ordinaires. C’est
pourquoi on les refroidit afin de les mettre sous forme liquide. Ils prennent
alors place dans des réservoirs de tailles classiques. Le couple hydrogène H2
(combustible) et oxygène O2 (oxydant) constitue le mélange le plus
connu et il est actuellement utilisé sur Ariane 5
La
mise en commun du carburant et de l’oxydant produit une réaction chimique qui
engendre les gaz nécessaires au fonctionnement de la fusée. La combustion peut
être instantanée dans le cas de propergols hypergoliques ou se faire grâce à
un système d’allumage.
|
Oxydant |
Combustible |
Impulsion
(s) |
Rapport
de mélange |
|
O2 |
H2 |
440 |
4.02 |
|
O2 |
UDMH |
310 |
1.65 |
|
N2O4 |
Hydrazine |
292 |
1.34 |
|
N2O4 |
UDMH |
285 |
2.61 |
Les
divers composés chimiques sont soumis aux réactions suivantes :
Décomposition
catalytique de l’hydrazine :
3
N2H4 ->
4 (1-x)
NH3 +
(1+2x) N2
+ 6x
H2
avec
x égal au taux d’ammoniac que l’on choisit généralement proche de 0.3
pour obtenir un bon rendement et des pertes acceptables.
Réaction exothermique de formation de l’eau :
O2
+2H2 -> 2H2O
Le moteur-fusée à ergols liquides est plus performant, plus souple d'utilisation, généralement moins polluant mais plus coûteux et moins fiable. L'idée remonte au russe Konstantin Tsiolkovski (écrivain de science-fiction, 1857-1935), à la fin du XIXe. Si la désinformation américaine attribue sa mise en application à Robert H. Goddard (1882-1945), qui en 1926 lança une fusée à ergols liquide (kérosène/O2) montant à 30m (!) d'altitude, c'est l'ingénieur péruvien Pedro P. Poulet qui semble avoir été le premier à faire fonctionner (au sol) un tel moteur, dès 1895. Il fonctionnait à l'acide nitrique (HNO3, riche en oxygène) et à l'essence.
Les fussées actuelles emploient les couples d'ergols suivants:
N2O4 (peroxyde d'azote) /UDMH (petit nom pour UnSymetric DiMethylHydrazine, ou diméthylhydrazine asymétrique): Assez peu performant, ce couple est par contre stockable à pression et température ambiantes et présente l'avantage de son hypergolicité: les deux ergols s'enflamment spontanément par contact. Le N2O4 peut être remplacé par l'IRFNA ou le RFNA (dérives de l'acide nitrique), l'UDMH par le MonoMerthyl-Hydrazine. On appelle l'ensemble ergols azotés. O2 (oxygène)/ Kérosène: Si ce couple présente le défaut qu'est la nécessité de stocker cryogéniquement (-183°c) l'oxygène liquide et n'est pas hypergolique, il est plus performant et moins polluant que le précédant. O2 (oxygène) /H2 (hydrogène): L'hydrogène est stocké à -253°c, ce qui pose de sérieux problèmes techniques. De plus, sa faible densité rend les réservoirs encombrants. Mais ce couple est extrêmement performant et non polluant (il ne dégage que de l'eau). Les fusée les plus modernes l'emploient. La première à l'utiliser fut la Saturn I, dès 1960. D'autres couples, d'emploi plus marginal, existent. Citons le couple Oxygène/méthane de plusieurs projets russes, qui offirait un compromis entre l'hydrogène et le kérosène. Notons qu'il existe, pour la propulsion des satellites, de petits moteurs n'employant qu'un seul ergol, de l'hydrazine que l'on décompose (H2N-NH2 —> N2 + 2H2). Simple mais modestement efficace (~240 secondes d'Isp), ce carburant est de moins en moins employé, au profit des solutions à biergols. Au début de l'ère spatiale existèrent quelques gros moteur employant des monergols, comme le nitrométhane. Ce sont en fait des explosifs brûlant lentement.
Présentation des ergols liquides :
Les ergols liquides stockables sont relativement faciles d’emploi. Ils sont utilisés sur les premiers étages des lanceurs. Ils ont une grande souplesse d’utilisation: on peut éteindre et rallumer le moteur à volonté, on les stocke à température ambiante et leurs densités élevées permettent de les confiner dans des réservoirs de taille raisonnable. Leur gros avantage est le suivant : Ils s’enflamment spontanément dès qu’ils se rencontrent, ce qui facilite le démarrage des moteurs. On les dit hypergoliques.
Ariane 44 L (document extrait du cédérom : "Les images satellitales") Réactifs :
Pour l’EPS (étage propulsif stockable) d’Ariane 5 :
Le combustible est la monométhylhydrazine ou MMH de formule H2N – NHCH3. Le comburant est le peroxyde d’azote (N2O4). Pour les 1er et 2ème étages ainsi que les PAL (propulseurs d'appoint à liquide) d’Ariane 4 :
Le combustible est le UH25, c’est un mélange de 75 % de diméthylhydrazine ou UDMH de formule H2N – N (CH3)2 et de 25 % d’hydrate d’hydrazine de formule (N2H4,H2O). Le comburant est le peroxyde d’azote (N2O4).
Réactions chimiques :
Les réactions suivantes présentent l’avantage de s’amorcer spontanément dès que les réactifs sont mélangés (réaction hypergolique) et libèrent énormément d’énergie.
Avec la diméthylhydrazine ou UDMH : H2N – N (CH3)2 (l)+ 2 N2O4 (l) - > 3 N2 (g) + 4 H2O (g) + 2 CO2 (g)
Avec l’hydrate d’hydrazine de formule (N2H4,H2O) : 2 (N2H4,H2O) (l) + N2O4 (l) - > 3 N2 (g) + 6 H2O (g)
Avec la monométhylhydrazine ou MMH : 4 H2N – NHCH3 (l) + 5 N2O4 (l) - > 9 N2 (g) + 12 H2O (g) + 4 CO2 (g)
Environnement et sécurité : L'hydrazine et ses dérivés présentent une toxicité élevée. l'hydrazine est instable dès 50°C (risque d'explosion), s'oxyde spontanément à l'air et à température ambiante. Ces propriétés font de l'hydrazine et de ses dérivés des substances délicates à manipuler et à stocker.
II. Les propergols liquides
Les propergols liquides possèdent un avantage crucial par rapport aux propergols solides : ils peuvent être réglés ou arretés durant leur fonctionnement, puis remis en marche.
Un bon propergol liquide sera donc caractérisé par une impulsion spécifique élevée, ie la vitesse d’éjection des gaz sera le facteur déterminant pour en déterminer l’efficacité. Ainsi, puisque la vitesse d’éjection dépend de la température de combustion T0 et de la masse molaire M des gaz produits, l’efficacité d’un propergol sera d’autant plus grande que T0 sera élevée et M faible.
Cela étant dit, il ne faut pas non plus négliger totalement la densité des propergols, puisqu’une faible densité entraînera automatiquement des réservoirs plus grands donc un surplus en poids, ni la température de stockage ou la toxicité ou corrosivité des ergols.
A. Réactivité chimique
Nous avons déjà examiné sommairement dans le chapitre I les caractéristiques importantes des réactions de combustion ainsi que les éléments chimiques envisageables dans la constitution des réactifs. Nous allons ici nous intéresser plus particulièrement à ces éléments susceptibles d’être utilisés à l’état pur (ie sous forme de molécules mono- ou diatomiques) et se présentant alors sous forme liquide, donc abordables dans le cadre de notre présentation des propergols liquides, de même que des molécules un peu plus complexes contenant ces éléments. Nous traiterons dans ce paragraphe avant tout des aspects théoriques de ces réactifs. Les caractéristiques d’ordre " pratique " des propergols effectivement utilisés seront détaillés dans le paragraphe suivant concernant les types de propergols.
1. Oxydants
Il existe peu de " bons " oxydants. Les seuls éléments effectivement utilisables sont : l’oxygène, le fluor et le chlore. Cependant des composés contenant beaucoup d’oxygène sont également envisageables, tels que certains composés azotés ou le perchlorate, très utilisé (le perchlorate étant solide, il sera décrit dans le chapitre III ).
a) L’oxygène
L’oxygène O2 est l’oxydant le plus important. Son point d’ébullition se situe à –183°C, mais bien que cette température puisse paraître très basse, elle est bien maîtrisée. De plus l’oxygène liquide a une densité de 1,27 ; il est donc relativement lourd, ce qui est favorable du point de vue de l’encombrement et du poids du réservoir. C’est ainsi un oxydant très utilisé dans la propulsion de fusées. Il est d’ailleurs fréquemment noté LOX (pour Liquid Oxygen).
Il a été très utilisé avec le kérosène sur d’anciennes fusées et il l’est maintenant sur la navette spatiale américaine et sur Ariane 5 avec l’hydrogène liquide.
L’ozone O3 est également un excellent oxydant, meilleur encore d’ailleurs que O2. C’est justement pour cette raison qu’il est aussi agressif que le fluor, ce qui finalement est plutôt un désavantage. De plus il a tendance à se décomposer de façon explosive lorsque il est utilisé à trop forte concentration. Cependant un mélange à 25 % maximum d’O3 avec O2 est stable et serait donc un bon comburant potentiel. A vrai dire, le manque d’expérience concernant la préparation d’O3 en grande quantité comme il en recquiert pour la propulsion de fusées en a limité l’emploi jusqu’à maintenant.
b) Le fluor et ses dérivés
Le fluor est largement plus agressif que l’oxygène et libère bien plus d’énergie lors de la combustion que celui-ci. Il est liquide à –189°C, température proche de celle de O2. Sa densité est de 1,51, il est donc très lourd. L’impulsion spécifique développée lors de combustions avec F2 en comparaison à celle des combustions avec O2 augmente de 16 % avec l’ammoniac et de 11 % avec l’hydrazine, mais seulement de 2,5 % avec H2.
Cependant le fluor est si agressif qu’il réagit déjà avec beaucoup de matériaux utilisé en aéronautique. On peut remédier à ce problème car certains métaux se recouvrent d’une couche protectrice d’oxyde lorsqu’ils sont mis en contact avec le fluor. Malheureusement, de nombreux composés tels que ces oxydes sont dangereux, de même que l’acide fluorhydrique qui se forme au contact avec l’hydrogène est extrèmement corrosif. La réaction du fluor avec le carbone produit par ailleurs des gaz contribuant à l’effet de serre. C’est pour ces raisons que le fluor n’est pas utilisé actuellement.
Le mélange de fluor et d’oxygène permet d’atteindre des impulsions spécifiques encore plus élevées que pour une utilisation séparée. En effet le mélange idéal (FLOX) contient 60 à 70 % d’O2 et 30 à 40 % de F2. Ce mélange pourrait être utilisé comme hypergol pour des propulsions hybrides (propergol liquide injecté sur un propergol solide) avec des réactifs alcalins ou alcalinoterreux. Ces dispositifs seraient capables de développer des impulsions spécifiques voisines de celles du couple O2/H2.
L’utilisation du difluoride d’oxygène (OF2) est également discutée. Sa température d’ébullition est de –145C. Ce composé est plus dense que le fluor ou l’oxygène purs (d = 1,71 à –183°C), et est hypergolique. Son utilisation serait donc très avantageuse, mais il se décompose facilement et son coût est élevé.
c) Le chlore
Le chlore libère beaucoup moins d’énergie que l’oxygène lors de la combustion mais il est deux fois plus dense. Le dichlore pur Cl2 stocké à froid serait un propergol liquide, mais étant donné que de l’acide chlorhydrique se formerait lors de la combustion, son utilisation est exclue. On utilise cependant beaucoup de sels à base de chlore et d’oxygène comme constituants de propergols solides.
d) Composés azotés
L’azote lui-même n’est pas un oxydant. Toutefois des composés azotés renfermant de l’oxygène sont, eux, de bons oxydants.
Relativement dense (d=1,4), donnant des performances acceptables (Is = 220 s avec l’éthanol, CH3CH2OH, sous un pression de 20 Mpa), liquide dans un domaine de température très commode (de –41 °C à 86 °C), l’acide nitrique était un des oxydants les plus anciennements utilisés. Ses inconvénients étaient le caractère corrosif et la toxicité des vapeurs qu’il émettait, avec le kérosène, par exemple, ou les alcools.
On utilise désormais le tétraoxyde d’azote N2O4 (ou peroxyde d’azote), noté parfois NTO. Ce composé est hypergolique avec de nombreux réactifs. C’est l’oxydant standard des propergols stockables. Il a une densité de 1,45 et est liquide entre –9,3 et 21,15°C.
2. Réducteurs
a) L’hydrogène
L’hydrogène est de loin l’élément le plus léger. De plus il réagit avec de nombreux oxydants en libérant beaucoup d’énergie. C’est pour cela qu’il est le meilleur carburant actuel.
Son plus grand désavantage reste sa température d’ébullition de –253°C. Cette température est bien plus difficile à réaliser que celle exigée par LOX. Son stockage est donc limité à quelques heures, de même que son utilisation elle-même pose des problèmes dans les circuits d’alimentation mis à rude épreuve.
b) Les alcalins et les alcalinoterreux
Les éléments lithium et béryllium donnent du fait de leur grande différence d’électronégativité de grandes chaleurs de combustion. De plus les molécules formées lors de la combustion avec O2 ou F2 sont petites (surtout pour les couples Li/F2 et Be/O2).
Le problème fondamental de ces éléments est leur coût de production et paradoxalement leur grande réactivité. En effet il ne brûlent pas seulement avec de l’oxygène pur mais s’enflamment spontanément dans l’air. Les gaz formés sont également très toxique, ce qui limite leur utilisation possible à des étages supérieures de lanceurs.
Il n’ont pas fait l’objet de recherches particulière pour la propulsion.
c) Les boranes
Les boranes sont des composés de bore et d’hydrogène. La combustion de boranes développe des impulsions spécifiques comparables à celles d’hydrogène pur, mais sont bien plus denses et de température d’ébullition bien plus élevée. Le chaleur de réaction dépasse largement celle de H2 mais les molécules formées sont plus lourdes,ce qui explique les impulsions spécifiques obtenues. Les coûts de productions élevés ont limité jusqu’à maintenant leur utilisation.
B2H6 est liquide en dessous de –92°C. Le pentaborane B5H6 est liquide jusqu’à 60°C, et le décaborane B10H14 jusqu’à 150°C, ils seraient des combustibles idéaux. Ils sont toutefois relativement toxiques, les produits de réactions étant quant à eux inoffensifs.
d) Les hydrocarbures
Les premiers propergols liquides étaient de l’aniline et de l’alcool. Les hydrocarbures utilisés actuellement sont des kérosènes. L’énergie libérée provient majoritairement de l’hydrogène.
Il convient de citer ici les polybutadiènes et polyuréthanes, fondamentaux dans l’élaboration des propergols solides.
e) Les composés azotés
Les liaisons entre azote et hydrogène jouent une fois de plus un très grand rôle. Le composé le plus simple est naturellement l’ammoniac NH3. Utilisé dans les années 40, il a été remplacé par l’hydrazine N2H4, beaucoup plus chère mais plus facile à stocker. L’hydrazine est liquide de 2°C à 113,5°C. Sa densité est de 1 à 20°C mais de 0,982 à 50°C. Elle a un fort pouvoir réducteur, mais est aussi une base faible. Un mélange air-hydrazine est déjà susceptible d’exploser lorsque l’hydrazine atteint 4%. La présence d’hydrogène augmente sa stabilité en favorisant la décomposition en ammoniac plutôt qu’en hydrogène et nitrogène.
Les composés à base d’hydrazine tels que la monométhylhydrazine (MMH) ou la diméthylhydrazine asymétrique (UDMH) sont désormais largement répandus, étant moins chers que l’hydrazine elle-même, plus stables, donc moins susceptibles d’explosions, et liquides à température plus basse.
MMH densité 0,866 état liquide de -52,4 à 87,5°C
UDMH densité 0,791 état liquide de -58 à 63,9°C
Les propergols solides se présentent sous la forme de blocs caoutchouteux constitués par des mélanges comportant un comburant et un combustible, capables de brûler dès que l’on procède à leur inflammation.
Il existe avant tout deux classes de propergols solides : les propergols homogènes, également appelés propergols double base, qui contiennent dans leur molécule l’élément oxydant et l’élément réducteur, et les propergols hétérogènes, dits propergols composites, où l’élément oxydant est séparé de l’élément réducteur.
Les derniers développements en matière de performance ont toutefois mené à l’élaboration d’une nouvelle famille de propergols solides : les nitrargols.
Le schéma ci-dessous décrit l’évolution chronologique des propergols double base et des propergols composites :
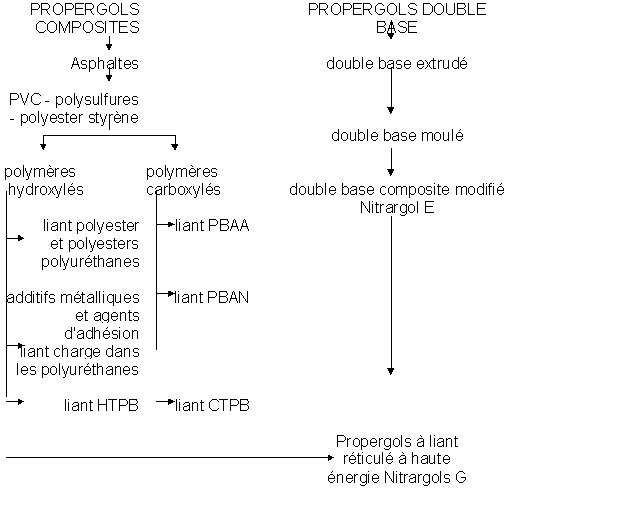
PBAA : polybutadiene – acrylic acid
PBAN : polybutadiene – acrylic acid – acrylonitrile
CTPB : carboxyl-terminated polybutadiene
HTPB : hydroxyl-terminated polybutadiene
Les propergols extrudés sont obtenus par extrusion à chaud, appelés SD, les propergols moulés sont dits Epictètes.
Les propergols constitués pour l’essentiel de deux bases énergétiques, à savoir la nitrocellulose et la nitroglycérine, associées en proportion variable sont appelés propergols à double base ou simplement double base. Les éléments oxydants et réducteurs mis en jeu dans la libération d’énergie par combustion sont associés dans la même molécule. Utilisés initialement comme poudre à canons, ils se sont progressivement imposés comme carburants dans les propulseurs de fusée, roquettes… C’est pour cet usage qu’on leur a ajouté des additifs divers.
Les constituants de ces propergols peuvent être fonctionnellement classés en cinq grands groupes de produits :
1. La base énergétique
La base énergétique de ces propergols est composée essentiellement de nitrocellulose (de 40 à 67 %) et de nitroglycérine (de 15 à 41 %). Parfois d’autres produits nitrés tels que la nitroguanadine sont également utilisés.
Les nitrocelluloses ou nitrates de cellulose sont des esters nitriques obtenues par action d’un mélange sulfonitrique sur le cellulose. Cette réaction a lieu en phase hétérogène par action des bains nitrants sur la fibre cellulosique, les trois fonctions alcools du cycle anhydroglucose pouvant être estérifiées. (La cellulose est un polyholoside de formule brute (C6H10O5)n ).
Une caractérisation importante des nitrocelluloses est le degré de polymérisation qui est égal au nombre de maillons anhydroglucoses formant la chaîne cellulosique.
Le taux d’azote est une indication directe du niveau énergétique du produit et représente le taux de fonctions alcools substitués par la fonction O-NO2. La valeur énergétique de la nitrocellulose de taux d’azote variant de 11,6 à 13,4 % se situe entre 3500 et 4400 J/g.
La nitroglycérine ou trinitrate de glycérine se présente sous l’aspect d’une huile incolore. Elle est obtenue par nitration de la glycérine par un mélange sulfonitrique. Sa valeur énergétique est très élevée : 7300 J/g.
Sa formule est :
CH2 – O – NO2
CH – O – NO2
CH2 – O – NO2
La nitroguanadine est utilisée comme ralentisseur de combustion (les autres produits peuvent être le dinitrate de triéthylèneglycol ou le trinitrate de butanetriol).
Sa formule est :
NH2 – C – NO2
NH
La fabrication des propergols double base consiste à associer de manière homogène ces deux produits selon un processus de gélatinisation qui repose sur les mécanismes d’interaction (tels que les forces de Van der Waals, les liaisons hydrogènes ou les forces d’interaction entre dipôles) entre les molécules de nitroglycérine introduites au sein du réseau des macromolécules de nitrocellulose et les atomes ou groupes d’atomes de ces polymères.
L’oxygène (basique) des groupes carboxyles de nombreux solvants à caractère basique (cétones, esters, alcools…) peut interagir sur l’hydrogène (acide) des groupes nitrates secondaires (CH-O-NO2) de la nitrocellulose. La nitroglycérine quant à elle est un mauvais solvant qui ne forme pas de vraie solution avec le polymère. Une des explication envisagée repose sur la présence de ponts oxygènes dans la molécule de nitrocellulose. Par suite de la rigidité des chaînes et de leurs dispositions dans l’espace, ces oxygènes sont en interaction faible avec les groupes nitrates des molécules de nitrocellulose. L’introduction de solvants mobiles tels que la nitroglycérine permet d’amener des groupements nitriques au voisinage des ponts oxygènes. Il y a alors interaction entre les oxygènes de la nitrocellulose et l’hydrogène du groupe CH-O-NO2 de la nitroglycérine. Ainsi, une partie de la nitroglycérine (30 %) sert à solvater la nitrocellulose, l’excès se trouvant plus ou moins mobile dans le réseau. Ce début de processus de gélatinisation est souvent marqué par un gonflement.
2. Les additifs de faisabilité
Les additifs de faisabilités doivent favoriser la mise en œuvre du matériau. Il s’agit essentiellement de plastifiants inertes destinés à faciliter le phénomène de gélatinisation. Ils constituent 0 à 10 % du propergols. De type phtalate ou triacétate, notamment, ils modifient les propriétés mécaniques du propergols et peuvent désensibiliser la nitroglycérine permettant d’éviter son utilisation à l’état brut.
Il s’agit généralement de :
3. Les additifs de stabilité
Les ester nitriques des propergols double base se déconposent dès la température ambiante. Cette décomposition correspond à la coupure des liaisons O-NO2. Elle libère des oxydes d’azote. En l’absence de stabilisant, les espèces produites ont un effet catalytique sur la réaction. En présence de stabilisants qui possèdent généralement un noyau aromatique capable de fixer par substitution les oxydes d’azote, la réaction est bloquée.
Cette décomposition présenterait de graves inconvénients au plan de la sécurité (cette réaction exothermique pouvant enflammer le propergol), au plan de la qualité (risque de fissuration) et au plan des performances (l’exothermicité de la décomposition diminuant l’énergie disponible pour l’utilisation).
Les stabilisants les plus utilisés sont :
4. Les additifs balistiques
La vitesse de combustion de ce type de propergol varie fortement avec la pression si bien que lors du fonctionnement, de faibles fluctuations de serrage se traduisent par des variations notables de pression. De ce fait, une augmentation accidentelle de la surface de combustion se traduit par une surpression pouvant aller jusqu’à l’explosion du propulseur.
On emploie pour cette raison des additifs balistiques.
Certains de ces additifs permettent d’obtenir dans un domaine de pression donné, une vitesse de combustion indépendante de la pression (effet plateau) voire une vitesse de combustion décroissante avec la pression (effet mesa). Ces effets correspondent ainsi à une accélération de la vitesse du mélange sans additif, d’où leur noms d’accélérateurs de combustion.
Il s’agit majoritairement de composés métalliques, notamment de sels ou d’oxydes de plomb (comme l’oxyde basique PbO ou l’oxyde salin Pb3O4).
5. Les additifs de fonctionnement
Certaines caractéristiques particulières liées à l’utilisation du propulseur ou à son architecture peuvent réclamer des additifs supplémentaires. Ainsi quelle que soit la configuration de la chambre, le régime de la combustion doit être stable et ceci peut nécessiter la présence, dans les gaz de combustion, de particules solides destinées à réduire les instabilités.
Caractéristiques des propergols double base :
La densité moyenne est de 1,55 à 1,66 pour les propergols SD, et de 1,50 à 1,58 pour les Epictètes.
6. Caractéristiques énergétiques
La combustion des propergols double base libèrent les produits de décomposition de la nitrocellulose et de la nitroglycérine, donc majoritairement des oxydes de carbone, d’azote, et de l’eau.
L’impulsion spécifique de ces propergols ne dépasse pas 210 s, mais leur élaboration est plus simple que celle des propergols composites.
Les propergols solides composites sont constitués d’un matrice polymérique souvent réductrice, chargée d’un solide pulvérulent oxydant et éventuellement d’un métal pulvérulent jouant le rôle de réducteur d’appoint. Les espèces oxydantes et réductrices ne sont donc pas présentes à l’intérieur de la même molécule.
Leurs constituants se classent en deux parties : le liant et les charges.
1. Le liant
Dans un propergol composite, l’oxydant et le réducteur sont sous forme solide pulvérulente, ce qui suppose pour assurer la cohésion et l’homogénéité de l’ensemble, la présence du liant.
Il doit être :
Ainsi, bien que son taux ne dépasse pas 20 à 30 % de la masse totale du propergol (alors que l’oxydant, faisant partie des charges, en constitue 50 %), il est extrèmement important en raison de son incidence sur les propriétés physiques et mécaniques.
Il est constitué essentiellement d’un prépolymère, mais contient aussi un réticulant, des stabilisants et divers additifs.
a) Le prépolymère
Le prépolymère est le constituant principal du liant du propergol composite (70 à 80 % du liant). C’est donc lui qui confère au liant l’essentiel de ses propriétés. Celles-ci peuvent être liées à la nature de la chaîne polymérique ou à la nature des extrémités fonctionnelles. En effet, schématiquement, le prépolymère est une molécule difonctionnelle formée de la répétition (plusieurs dizaines de fois) d’un motif monomère (butadiène, oxyde de propylène,…) et se terminant par les fonctions réactives se situant en bout de chaîne.
i) Caractéristiques liées à la chaîne
L’enthalpie de formation D Hfo contribue à rendre le propergol d’autant plus énergétique qu’elle est élevée. Elle est directement liées à la nature des liaisons entre atomes de la chaîne (C, H, O, N). De plus, il est nécessaire que le liant soit constitué d’atomes légers qui par combustion donneront des gaz favorisant une impulsion spécifique élevée.
Le taux d’oxygène fait apparaître le fait que seul l’oxygène présent dans le liant compte comme valences oxydantes. Plus il est élevé, moins il devient nécessaire pour atteindre l’impulsion spécifique maximale d’utiliser des taux élevés d’oxydant. Mais l’incorporation de taux élevés par des liaisons de type éther, ester ou carbonates s’accompagne d’une diminution de l’enthalpie de formation, d’où leur faible intérêt sauf pour les propergols " froids ". En pratique la chaîne polybutadiène réalise un très bon compromis énergétique malgré une densité quelque peu plus faible que celle des liants oxygénés.
La masse molaire moyenne est liée au nombre de motifs monomères qui constituent la chaîne du prépolymère. Elle est donc importante pour la masse moléculaire moyenne entre ponts dans le liants, et en ce qui concerne la viscosité de la pâte de propergol, étant donné que le propergol est coulé dans un moule.
ii) Caractéristiques liées aux extrémités fonctionnelles
La fonctionnalité doit être de 2 pour assurer une bonne constitution du réseau. Ceci est effectivement vérifié pour beaucoup de polymères du tableau I suivant. Les fonctions réactives, idéalement, doivent se trouver en bout de chaîne pour profiter de toute sa longueur et de sa mobilité. En pratique les terminaisons les plus utilisés sont les terminaisons hydroxyles et carboxyles dont le mode de réticulation est rappelé dans le tableau II.
Tableau I :
|
Polymère |
Chaîne |
Densité |
D Hfo |
Mp |
Taux d'oxygène |
|
g/cm3 |
Kcal/kg |
% en masse |
|||
|
Polyisobutylène |
|
0,91 |
-375 |
> 100000 |
0 |
|
Polybutadiène |
|
0,92 |
5 |
1500/5000 |
5 |
|
Polyéther |
|
1,05 |
-895 |
1500/3000 |
26 |
|
Polyester |
|
1,19 |
-1070 |
1000/2000 |
35 |
|
Polysiloxane |
|
0,87 |
-1890 |
30000 |
21 |
Tableau II :
|
Nature des terminaisons du prépolymère |
Système réticulant |
Fonctions formées |
|
Hydroxyle (-OH) (polybutadiène, polyoxypropylène, polyester) |
Triol + diisocyanates |
Uréthane – O – C – N – O H |
|
Carboxyle (-COOH) (polybutadiène, polyester) |
1) Polyépoxyde
2) Polyaziridine |
Ester alcool – C – O – CH2 – CH – O OH Ester amine – C – O – CH2 – CH – O NH2 |
b) Le réticulant
Le réticulant peut être le plus simplement une molécule polyfonctionnelle (au moins trifonctionnelle) de faible masse molaire ou, d’une manière plus complexe, un mélange de petites molécules difonctionnelles, appelées extenseurs de chaîne dont le rôle est d’accroître la longueur la chaîne du prépolymère, et molécules au moins trifonctionnelles de façon à assurer à l’ensemble du système réticulant une fonctionnalité (nombre de fonctions réactives, divisés par la nombre total de molécules) moyenne supérieure à 2.
Trois types de réactions de polyaddition sont utilisés de façon classique pour les propergols solides :
Les isocyanates R1 – N = C = O réagissent sur la plupart des alcools R2 – OH selon la réaction :
R1 – N = C = O + R2 – OH ® R1 – N – C – O – R2
H O
Le pont – N – C – O – est appelé uréthane.
H O
R1 – C – OH + R2 – CH –CH2 ® R1 –C – O – CH2 – CHOH – R2
O O
R1 – C – OH + R2 – C – CH2 ® R1 – C – O – CH2 – CH – R2
O N H O NH2
Le taux de réticulation joue un rôle important sur les propriétés mécaniques du propergol. Au dessous d’un certain taux de réticulation, le propergol est insuffisamment réticulé. Au dela de cette limite, les allongements et les contraintes maximales croissent, ce qui est un comportement très général de ces compositions.
c) Le plastifiant
Il joue un rôle d’appoint essentiel pour réduire la viscosité de la pâte, donc la facilité de mise en œuvre. C’est en général une huile non réactive vis-à-vis du polymère, véritable diluant dont le rôle est d’écarter les chaînes de polymères et de réduire ainsi leurs interactions, aussi bien à l’état liquide qu’à l’état réticulé.
d) Les additifs
i) Modificateurs de combustion
Ils servent à ajuster la vitesse de combustion du propergol, au delà de ce que permet la variation de la granulométrie des charges. On en distingue deux types :
Ils accélérent la décomposition du perchlorate ou abaissent la température de décomposition. Dans la quasi-totalité des cas ce sont des dérivés métalliques minéraux ou organiques du cuivre, du fer, du chrome, du bore. Longtemps seuls des solides ont été utilisés : oxydes de fer et chromites de fer. Cependant des dérivés liquides du fer et du bore sont utilisées car leur incorporation au liant en tant que plastifiants permet d’atteindre les taux élevés nécessaires aux grandes vitesses de combustion alors que le taux élevé de solides obligent à diminuer le taux de charge énergétique.
Il en existe deux types. Certains modifient la cinétique de décomposition de perchlorate d’ammonium. Ce sont en général des sels alcalins ou alcalino-terreux solides ajoutés à faibles taux (1 à 2 % du propergol). Ils sont inefficaces sur les propergols aluminisés.
On leur préfèrent donc les refroidissants, qui abaissent la température de combustion du propergol (donc abaissent malheureusement son pouvoir énergétique) par : abaissement de l’enthalpie, ou enrichissement des gaz de combustion en azote qui joue le rôle de diluant, ne participant pas à la combustion. Citons l’oxamide, la nitroguanadine et le nitrate d’ammonium.
ii) Autres additifs
Ils s’agit de catalyseur de réticulation, pour réduire le temps de cuisson du propergol (ce sont des sels organiques de métaux de transition), des agents de conservation (afin d’éviter l’oxydation, à l’aide de phénols ou d’amines aromatiques, et d’éviter l’hydrolyse), et des agents stabilisants de la combustion.
2. Les charges
Les charges sont de deux types :
Ce sont des solides pulvérulents dont la forme et la taille contrôlent le taux maximum que l’on pourra introduire dans le liant. En pratique trois à quatre types de particules sont utilisées dans les propergols, ce qui suffit pour approcher le maximum de taux de charges théorique optimum. La nature de ces charges est évidemment le paramètre principal qui influe sur l’énergie du système, mais elle joue aussi sur la vitesse de combustion, puisqu’elle détermine la température de combustion et la masse molaire des gaz éjectés.
a) Oxydants
Un bon oxydant est caractérisé par :
la possibilité de fournir de l’oxygène (ou du fluor) pour brûler le liant et le réducteur d’appoint avec le maximum de chaleur dégagée.
une enthalpie de formation aussi élevée que possible.
Les principaux oxydants sont réunis dans le tableau suivant :
|
Oxydant |
Oxygène " libre " % en masse |
Densité |
Température de décomposition (°C) |
D Hfo Kcal/kg |
|
Perchlorate d’ammonium NH4ClO4 |
34 |
1.95 |
>270 |
-601 |
|
Perchlorate de potassium KClO4 |
46.2 |
2.53 |
>500 |
-748 |
|
Nitrate d’ammonium NH4NO3 |
20 |
1.72 |
très stable |
-1098 |
|
Octogène (CH2N2O2)4 |
0 |
1.91 |
>200 |
+68 |
|
Nitroguanadine NH2 – C – NO2 NH |
-15 |
1.76 |
très stable |
+217 |
Le perchlorate d’ammonium est de loin le plus utilisé : dense, stable thermiquement, sa décomposition ne fournit que des gaz dont une forte proportion d’oxygène. Le nitrate d’ammonium, l’octogène et la nitroguanadine sont ensuite principalement utilisés.
Le nitrate d’ammonium conduit à des impulsions spécifiques beaucoup plus faibles que ceux obtenus avec les perchlorates, et convient donc surtout aux générateurs de gaz. Octogène et nitroguanadine ne sont pas des oxydants, mais ont des enthalpies de formation positives, donc sont utilisés comme charge d’appoint des propergols déjà fortement oxygénés.
b) Réducteurs
L’aluminium est le réducteur quasi universel des propergols composites. Il existe en poudres quasi sphériques de faibles diamètres, bien adaptées à la réalisation de taux de charges élevés. La fine couche d’alumine qui passive les grains vis-à-vis de l’humidité le rend facilement manipulable.
Le magnésium est un combustible intéressant, cependant beaucoup moins dense (1,7) que l’aluminium (2,7).
Carbone et hydrogène présents obligatoirement dans le propergol puisque constituants essentiels du liant participent d’une manière importante à l’exothermicité de la combustion, et présente le gros avantage par rapport à l’aluminium de donner des produits de combustion gazeux.
L’utilisation de polyuréthane donne de bons résultats tant du point de vue des propriétés mécaniques que sur le plan énergétique : avec le perchlorate d’ammonium, l’impulsion spécifique atteint 225 s.
Cependant les mélanges {polybutadiène + perchlorate + aluminium} donnent de meilleures performances, permettant des impulsions spécifiques de l’ordre de 270 s.
Les étages d’accélération à poudre d’Ariane V fonctionnent selon ce principe :
Perchlorate d’ammonium 68 %
Polybutadiène (PBHT) 14 %
Aluminium 18 %
Impulsion spécifique dans le vide : 273 s
Poussée au décollage : 6000 kN
Masse volumique : 1,750 g/cm3
La famille des Nitrargols regroupe l’ensemble des propergols constitués d’un liant énergétique, à base au moins d’un ester nitrique, dans lequel sont incorporées des charges solides oxydantes et éventuellement réductrices.
Les Nitrargols se situent, par leur constitution, entre les familles des propergols double base et celles des propergols composites – ce qui justifie leur appellation couramment utilisée : propergols double base composites. De ce fait, il est possible de mettre en œuvre les Nitrargols selon deux procédés très différents :
Les Nitrargols sont l’aboutissement de la recherche sur les performances des propergols traditionnels dans le domaine des engins tactiques et stratégiques. La gamme des Nitrargols G conduit aux niveaux énergétiques les plus élevés actuellement accessibles au stade industriel.
1. Les constituants des liants
a) Composition des liants de Nitrargols
Nitrargols E :
Les principaux constituants des liants de Nitrargols E sont les suivants :
Nitrargols G :
b) Les polymères
Les nitrocelluloses sont décrites dans le paragraphe relatif aux propergols double base : elles sont caractérisées essentiellement par leur taux d’azote. Il faut cependant noter que les nitrocelluloses sont des polymères semi-cristallins qui n’ont pas, comme les polyesters ou polybutadiènes, une souplesse de chaîne facilitant l’incorporation de forts taux de charges (de l’ordre de 70 à 80 %).
Actuellement, les prépolymères les plus utilisés sont les polyadipates d’éthylène ou de diéthylèneglycol et les polyoxyéthylèneglycols (PEG).
c) Les plastifiants
Les plastifiants énergétiques sont essentiellement des nitrates de polyalcools.
Parmi ces esters nitriques, la nitroglycérine reste le plastifiant de loin le plus employé à cause des valeurs élevées de son potentiel calorimétrique et de sa masse volumique.
Les plastifiants inertes incorporés dans les Nitrargols sont identiques à ceux utilisés dans les propergols double base.
d) Les systèmes réticulants
La réticulation est nécessaire :
2. Les charges
a) Les oxydants
On trouve principalement :
Ces dernières se classent en deux catégories :
Les nitramines sont de puissants explosifs, sensibles au choc et à la friction. Leur manipulation devra donc se faire avec toutes les précautions inhérentes aux explosifs secondaires pulvérulents.
L’octogène étant plus dense, il conduit à des propergols plus énergétiques.
b) Les réducteurs
Il s’agit des mêmes réducteurs que pour les propergols composites, donc majoritairement d’aluminium.
3. Les additifs
Les additifs sont semblables aux additifs des propergols double base et composites, tels que stabilisants chimiques pour éviter la décomposition des esters nitriques ou d’autres additifs divers.
Il existe une nomenclature très couramment utilisée en France pour les propergols composites et les Nitrargols G : le nom est constitué d’un préfixe, d’une ou plusieurs consonnes et d’un suffixe.
Le préfixe donne une indication qur le liant :
NITRA pour un liant contenant un ester nitrique
BUTA pour un liant basé sur le polybutadiène
ISO pour un liant basé sur un polyuréthane.
Les lettres centrales indiquent la nature de la charge énergétique :
L pour le perchlorate d’ammonium
M pour l’hexogène ou l’octogène
P pour le perchlorate de potassium.
Le suffixe indique la nature du combustible métallique.
ANE pour l’aluminium
AZE pour le zirconium
ITE pour indiquer l’absence de métal.